Introducción:
En los procesos electrolíticos, el depósito del metal se logra usando una fuente de energía externa (voltaje) que produzca una corriente eléctrica dentro de la solución o baño. Aunque en muchos casos, se utilizan recetas de operación que dan resultados mas o menos consistentes, siempre resulta conveniente entender un poco mas la ciencia que está detrás de la receta de operación, y ese es el objetivo de estos artículos. Y en esta ocasión comenzaremos a tratar el tema de las soluciones electrolíticas, siendo este un componente crucial para el éxito de un proceso de recubrimiento electrolítico.
En el artículo "Electrolitos, leyes de Faraday y cálculos del proceso electrolítico. Primera parte" hacemos una introducción básica del concepto del electrolito o solución iónica electrolítica.
Una celda de recubrimiento electrolítico consta básicamente de los siguientes componentes: 2 electrodos metálicos (cátodo y ánodo) y una solución acuosa usada para disolver iones de dos tipos, cationes y aniones. En el momento en que se sumergen los electrodos y entran en contacto con la solución, se realizan dos interacciones fisicoquímicas llamadas interfaces: cátodo-solución y ánodo-solución. En la celda también hay otros elementos como el rectificador de corriente, agitadores, calentadores, etc. En esta ocasión nos centraremos en la solución electrolítica. Toda la conformación de la celda existe para realizar un proceso de transformación precisamente en esas regiones llamadas interfaces.
Solo como recordatorio, en aquel artículo mencionamos que cuando una pieza de metal se sumerge en una solución acuosa que contiene iones de ese metal, Meᶻ⁺ , se realizará un intercambio de iones del metal entre dos fases, es decir entre el metal y la solución. Es decir, algunos iones del lattice del metal Meᶻ⁺ (sólido) entran en la solución y viceversa.
Por lo general, sin considerar la circulación de corriente eléctrica en el circuito, durante cierto tiempo después de la inmersión, el lattice de la pieza metálica sólida "cede" mas cationes a la solución que los que absorbe creándose un desequilibrio de cargas, entonces en ese periodo, el lattice se queda con un exceso de electrones y por tanto adquiere carga negativa que tenderá a auto-equilibrarse por la razón de que aumenta la atracción de mas iones positivos Meᶻ⁺ desde la solución durante ese tiempo produciéndose una oxidación (cesión de electrones) por parte del metal sólido y una reducción (adquisición de electrones) en la solución, sucediendo esto en la frontera entre ambas fases (región interfase). Después de un tiempo de producirse dicho fenómeno, se alcanza un equilibrio de cargas en la interfase, lo que lleva a que a partir de ese momento, el intercambio neto de iones entre ambas fases sea cero, es decir por cada ion que "brinca" del metal a la solución otro "regresa" desde esta hacia el metal (qm=-qs). Como resultado de este proceso de equilibrio entre ambas fases se crea una diferencia de potencial o voltaje de polarización de equilibrio, el cual puede determinarse experimentalmente mediante métodos estándar para cada conjunto de metal de electrodo y solución. Esta es la tensión o voltaje de polarización que debe ser superada entre al ánodo y el cátodo para que se pueda inducir mediante una fuente de voltaje externa, una circulación de corriente en la celda electrolítica. En la tabla 1 se muestran algunos ejemplos de tensiones de polarización determinadas experimentalmente, las cuales se les conoce como "potencial de electrodo estándar" Eₒ , un dato que es usado en diversos cálculos de proceso que se describirán mas adelante en otros artículos.
Esta tensión de polarización de equilibrio es dependiente del tipo de sal electrolítica, su concentración en la solución acuosa, la temperatura y los electrodos. Para mas detalles acerca de este tema le invitamos a revisitar el artículo. En esta ocasión, explicaremos un poco mas acerca de la naturaleza fisicoquímica y de las distintas variantes de solución iónica, por ser, como vimos en la introducción a este tema, uno de los temas técnicos mas importantes en la conformación de un proceso de recubrimiento por electrolisis. Gracias por visitarnos.
Que es la solución electrolítica?
Las soluciones electrolíticas acuosas usadas en procesos de acabados de recubrimiento metálico por electrodeposición son principalmente soluciones de sales metálicas, las cuales en solución, es decir, disueltas en agua, se disocian para formar aniones y cationes con carga eléctrica.
Estos iones pueden ser cationes de metal simple Meᶻ⁺ , iones complejos con carga positiva o iones de hidrógeno positivos H+. De igual forma, pueden aparecer especies de ácido ionizado con carga negativa, complejos iónicos con carga negativa o iones de hidróxilo con carga negativa OH-.
Soluciones basadas en iones simples
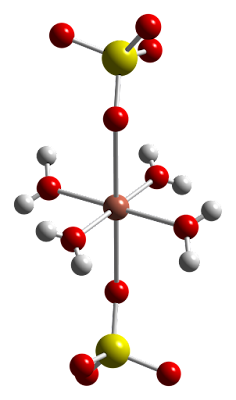
Al disolverse en agua, los iones cargados quedan rodeados por una "capa" de moléculas de agua sujetas al ion por enlaces iónicos de tipo puente electrostático (puente de hidrógeno), tal como se muestra en la imagen 1A, que representa un sistema iónico de sulfato de cobre en disolución. En la imagen 1B se muestra la estructura molecular de Pentahidrato Sulfato de Cobre en forma de sal y en la imagen 1C una célula completa del mismo compuesto iónico agrupado.
Nótese como en este último caso (imágen 1C) el ion de cobre (naranja Cu²⁺) forma una estructura 6-coordinada conectándose a 4 moléculas de agua (H₂O ) (1 rojo-2 blancos) y dos ligaduras iónicas con iones de Sulfato (SO₄)²⁻ (1 amarillo-4 rojos).
El compuesto Sulfato de Cobre en forma de sal (CuSO₄).5H₂O pentahidrato, es un cristal azul brillante también conocido como piedra azul ó vitriol de cobre (imagen 1D). Como pentahidrato, en forma sólida, tiene una estructura polimérica de estructura octaédrica, pero en ese caso ligado a 4 moléculas de agua y sus centros conectados a iones sulfato, tal como se muestra en la imagen 1B/1C.
Nótese como en este último caso (imágen 1C) el ion de cobre (naranja Cu²⁺) forma una estructura 6-coordinada conectándose a 4 moléculas de agua (H₂O ) (1 rojo-2 blancos) y dos ligaduras iónicas con iones de Sulfato (SO₄)²⁻ (1 amarillo-4 rojos).
El compuesto Sulfato de Cobre en forma de sal (CuSO₄).5H₂O pentahidrato, es un cristal azul brillante también conocido como piedra azul ó vitriol de cobre (imagen 1D). Como pentahidrato, en forma sólida, tiene una estructura polimérica de estructura octaédrica, pero en ese caso ligado a 4 moléculas de agua y sus centros conectados a iones sulfato, tal como se muestra en la imagen 1B/1C.
Al disolverse en agua libera calor formándose en solución, iones de cobre Cu²⁺ y iones sulfato (SO₄)²⁻ rodeados por una capa u hoja de 6 moléculas de agua (H₂O) también de geometría octaédrica. (imagen 1A)
Como puede verse, la orientación de las moléculas de agua que rodean los iones varía dependiendo de si están rodeando al ión cargado positivamente (Cu²⁺) o bien si rodean al ión negativo (SO₄)²⁻.
Esto sucede debido a la naturaleza dipolar de las mismas moléculas de agua. Recordemos que las moléculas de agua forman "puentes de hidrógeno" entre si que es lo que mantiene la cohesión del agua en estado líquido. Por un lado, en una molécula de agua, el átomo de oxígeno se liga a los dos átomos de hidrógeno mediante enlaces covalentes fuertes (comparten electrones equilibrándose), pero los pequeños desequilibrios de carga electrostática crean a su vez enlaces iónicos puente ligados mediante atracción electrostática mas débiles (puentes de hidrógeno) que mantienen unidas las moléculas de agua unas con otras. Estos enlaces puente mas débiles se crean por la atracción iónica negativa del átomo de oxígeno y la atracción iónica positiva de los átomos de hidrógeno de otras moléculas. Por lo regular dos átomos de hidrógeno de diferentes moléculas (A y B), se ligarán de esa forma a un átomo de oxígeno de una tercer molécula (C) así como se muestra en la imagen 2.
Entonces, volviendo a la solución iónica, como puede verse en la imagen, las moléculas de agua formarán enlaces tipo puente iónico (ligandos) con los iones positivos (cationes) de cobre (Cu²⁺ ) usando los átomos de oxígeno de múltiples moléculas de agua, mientras que alrededor del ión negativo (anión) sulfato (SO₄)²⁻ se agruparan moléculas de agua formando enlaces tipo puente iónico (ligandos) con los 2 átomos de hidrógeno de múltiples moléculas de agua. Estas agrupaciones formarán una "hoja" o "capa" de agua alrededor de los iones.
El número de moléculas de agua que rodean los iones positivos o negativos no tiene que ver con el número de valencia de los iones y la cantidad se determina por otros factores de tipo fisicoquímico que no analizaremos aquí. Solo comentaremos que en el caso de iones metálicos, estas formaciones se dan en grupos de 4, 6 u 8 moléculas de agua por ión y forman las configuraciones espaciales geométricas que se muestran en la imagen 3 (tetraedro, octaedro y cúbica).
Soluciones basadas en iones complejos
Este mismo comportamiento fisicoquímico se presenta en las soluciones basadas en moléculas iónicas complejas, que son muy usadas en procesos de recubrimiento metálico electrolítico. Las moléculas iónicas complejas son moléculas de orden superior formadas a partir de iones simples de orden inferior. Y al conformarse de esa manera, los iones centrales inferiores o simples quedan blindados por completo ya sea por ligandos iónicos (con polarización) o bien por ligandos conectados mediante ligaduras del tipo Van der Waals (es decir no polarizadas), y sus propiedades varían considerablemente respecto a las propiedades de las moléculas mas simples de las que se forman.
Descrito de manera simple, una molécula iónica compleja se forma de la siguiente manera:
Alrededor de un ión central, en muchos casos un metal pesado, se agrupan a manera de "hoja" o "capa" los ligandos (tal como se describió con las moléculas de agua alrededor de iones simples). Los ligandos son otros iones mas simples y también otras moléculas sin polarización de carga.
Estas moléculas iónicas simples y moléculas sin carga, llamadas comúnmente "especies", son los "ligandos". Los ligandos que rodean al ión central se ordenan de formas geométricas determinadas alrededor de este. El número de ligandos es el número de coordinación del ión complejo, expresado comúnmente como "n-coordinado", por ejemplo si alrededor del ión central se conectan 4 ligandos, el ión complejo es 4-coordinado. Este número no depende del número de valencia del ión y el tipo de enlaces son puentes iónicos electrostáticos o puentes del tipo Van der Waal no polarizado, y tal como se describió párrafos atrás, las formaciones en iones metálicos se dan en grupos de 4, 6 u 8 ligandos por ión central formando las configuraciones espaciales que se muestran en la imagen 3.
Por lo regular, estas "especies" que conforman los ligandos, son mas grandes que los propios iones centrales, por tanto dentro del ión complejo, el ión central queda mas o menos completamente blindado, lo cual hace que sus propiedades químicas cambien por completo a cuando se presenta en solitario.
La Imagen 4 muestra gráficamente esto descrito, Lⁿ⁻ son los ligandos con carga negativa de valor n, en este caso, Zᵐ⁺ es el ion central con carga positiva de valor m. Mientras que k es el valor de carga neta del ion complejo, que puede ser positiva o negativa siendo cero un valor de carga iónica neutra.
Muchos electrolitos usados en recubrimiento con acabado metálico se basan en iones complejos.
Un ejemplo es el Hexacianoferrato de Potasio (II) K₄[Fe(CN)₆ ]. En la imagen 5 se muestra como se disocia en solución formando 4 cationes de potasio (K) y 4 aniones complejos con un ión central de Hierro (Fe) ligado a 6 ligandos de Cianuro. Comentar además, que este ion complejo es usado no solo en recubrimientos electrolíticos sino en múltiples aplicaciones como fertilizante agrícola, producción de vino, ácido cítrico, agente oxidante en múltiples industrias químicas y en la obtención de cobre a partir de mineral de molibdeno. (ref. https://www.geeksforgeeks.org/potassium-hexacyanoferrate-ii-formula-structure-properties-uses-sample-questions/)
Iones complejos quelatados
Además de la formación de iones complejos como los mostrados, existen otros complejos que involucran ligaduras iónicas cuyos ligandos no solo "conectan" una vez con el ión central (1-coordinado) sino que de la misma molécula, se forman conexiones en puntos múltiples (n-coordinado) con el ión central. A estos complejos con ligandos n-coordinados se les llama "quelatados" (del inglés chelated).
Los ligandos que forman este tipo de complejos se les conoce como "especies quelatadas" o "quelantes". Ejemplos de estos complejos son el ácido Etilen-diamina tetraacético (EDTA) y el Etilen-diamina-tetra-2-hidroxipropano (quadrol) cuyas fórmulas se muestran en la Imagen 6. Mientras que en la imagen 6A se muestra su fórmula estructural y en la imagen 6B el diagrama estructural molecular del EDTA.
Asimismo, en la Imagen 6C se muestra una estructura molecular de un ion complejo de cobre 6-coordinado por una molécula de EDTA. Nótese como 4 ligaduras al ion Cu²⁺ se realizan con moléculas de hidróxido (OH-) de cada una de las 4 moléculas de ácido carboxílico (HOOC) en donde se sustituye el H por el enlace al ion de cobre, mientras que la molécula de EDTA completa la 6-coordinación del ion metálico a través de los dos átomos de nitrógeno (N) vinculadas a su vez con el carbono de las 6 moléculas de metileno (CH₂) que conforman la EDTA. De esa forma el ion de cobre queda completamente blindado por una sola molécula de EDTA formando un ion complejo quelatado.
Esfera Blanca = Átomo de Hidrógeno
Esfera Roja= Átomo de Oxígeno
Esfera Negra = Átomo de Carbono
Esfera Azul = Átomo de Nitrógeno
Esfera Naranja = Ión de Cobre
Parametrización de electrolitos usados en electrodeposición, galvanoplastia o procesos electrolíticos
Como dijimos, para realizar recubrimientos electrolíticos, son usados electrolitos acuosos conocidos como baños electrolíticos o simplemente baños que pueden estar basados en sales de iones metálicos simples, iones complejos o iones complejos quelatados, cada una de estas variantes con propiedades fisicoquímicas únicas que presentan ventajas y desventajas dependiendo del tipo de recubrimiento buscado. En todas, la principal constituyente es la sal del metal a depositar, y pueden llevar añadidos como ácido o un alkali para promover la conducción mas aditivos que ayuden a optimizar las propiedades del depósito.
En el caso de los procesos electrolíticos, el depósito del metal se logra usando una fuente de energía externa (voltaje) que produzca una corriente eléctrica dentro de la solución o baño, que como ya vimos debe aplicarse como mínimo el voltaje de polarización que surge por el efecto de intercambio iónico inter-fase entre la estructura cristalina del electrodo y la solución acuosa.
A este proceso en inglés se les conoce como "electroplating" y en español "galvanizado" o "galvanoplastia". Por otro lado existen procesos que no requieren la circulación de corriente eléctrica conocidos como "electroless plating" que sería algo así como "metalizado sin electricidad", pero en este caso no hablaremos de ellos.
Se han desarrollado miles de diferentes "baños electrolíticos" con el fin de lograr y optimizar resultados particulares de recubrimiento de metales usando proceso electrolítico (electroplating).
Hay múltiples formas de caracterizar ó parametrizar estos baños electrolíticos siendo la mas conocida el llamado potencial de hidrógeno (PH).
Potencial de Hidrógeno (PH).
Basado en el parámetro potencial de hidrógeno (PH) se tienen soluciones o baños ácidos (PH<3), baños neutros (PH aprox. 7) y baños alcalinos (PH >9). En el caso de este parámetro es importante considerar que no debe haber cambios de PH durante el proceso de electrodeposición y esta es la razón por la que a la solución se le adiciona ácido, alcalís o potenciadores (buffers).
En próximos artículos sobre este tema de los baños electrolíticos explicaremos a detalle cada uno de los tipos de soluciones, ácidas, neutras y alcalinas, así como algunos otros tipos de soluciones como las cianuradas, por ejemplo el cianuro de cobre (CuCN), soluciones alcalinas no cianuradas, así como algunos aditivos que se agregan, tanto en forma de sales inorgánicas como orgánicas con el fin de incrementar la estabilidad del baño, nivelación y distribución uniforme del depósito, optimización de la reacción química, mejora de resistencia a la corrosión, brillantez, reflectividad, dureza, resistencia mecánica, ductilidad, resistencia al estrés interno, a la deformación, soldabilidad, etc. Es decir para mejorar características y/o parámetros del recubrimiento. (Ir a artículo acerca de las especificaciones y requerimientos del recubrimiento electrolítico)
La concentración y conformación química de la solución electrolítica es un factor crítico, como lo es también la calidad con la que el rectificador de corriente suministra el voltaje y corriente al conjunto electrolítico. Algunos procesos por ejemplo, no permiten una variación vibratoria de la corriente, conocida como rizo de salida, mayor al 10% del valor nominal debido a que el resultado del recubrimiento acabará siendo algo muy distinto a lo esperado (línea roja en la imagen 7). Novak ha desarrollado sus rectificadores tomando en cuenta todos estos factores que a lo largo de casi 30 años sus clientes le han manifestado y solicitado en sus necesidades particulares. Por ejemplo, los rectificadores Novak presentan un rizo menor al 1% (5% en salidas de alta potencia) gracias a la topología conmutada de puente completo basada en el transistor mosfet de potencia. Acerca de eso hablaremos mas en artículos posteriores.
Por lo pronto lo invitamos a que conozca mas acerca de nuestra oferta de rectificadores para galvanoplastia Novak, visitando nuestra tienda en línea. Que tenga un buen día.
Atribuciones:
1B) https://commons.wikimedia.org/wiki/File:Copper(II)-sulfate-pentahydrate-Cu2-coord-xtal-2007-CM-3D-balls.png Benjah-bmm27, Public domain, via Wikimedia Commons
1C) https://en.wikipedia.org/wiki/File:Copper(II)-sulfate-pentahydrate-unit-cell-1985-3D-bs-17.png This work has been released into the public domain by its author, Benjah-bmm27. This applies worldwide.In some countries this may not be legally possible; if so:Benjah-bmm27 grants anyone the right to use this work for any purpose, without any conditions, unless such conditions are required by law.
1D) https://commons.wikimedia.org/wiki/File:Copper_sulfate.jpg. Stephanb, CC BY-SA 3.0 <https://creativecommons.org/licenses/by-sa/3.0/>, via Wikimedia Commons
2)https://commons.wikimedia.org/wiki/File:3D_model_hydrogen_bonds_in_water.jpg. translated by Michal Manas (User:snek01), Public domain, via Wikimedia Commons
6B)https://es.wikipedia.org/wiki/Archivo:EDTA-from-xtal-1972-3D-balls.png. Este trabajo ha sido liberado al dominio público por su autor, Benjah-bmm27. Esto aplica para todo el mundo. En algunos países esto puede no ser legalmente factible; si ello ocurriese: Benjah-bmm27 otorga a cualquier persona el derecho de usar este trabajo para cualquier propósito, sin ningún tipo de condición, a menos que éstas sean requeridas por la ley.
6C)https://www.wikidoc.org/index.php/EDTA. This page was last edited 21:12, 15 April 2015 by Aparna Vuppala. Based on work by wikidoc users Rim Halaby, WikiBot and Matt Pijoan. Content is available under Creative Commons Attribution/Share-Alike License unless otherwise noted; All rights reserved on Board Review content.
7)https://commons.wikimedia.org/wiki/File:RC_filter.svg. Krishnavedala, CC BY-SA 4.0 <https://creativecommons.org/licenses/by-sa/4.0>, via Wikimedia Commons
Nota: El contenido de este artículo es con fines informativos y didácticos básicos, no pretende ser o aportar información técnica que pueda ser usada para diseñar, dimensionar o definir un proceso industrial o de laboratorio en la práctica. Al margen de lo que en estos artículos se describa, usted debe considerar que cualquier diseño, ingeniería o dimensionamiento de proceso que se requiera, deberá ser realizado y/o validado técnicamente por un especialista en el área debidamente acreditado












-ion.png)









